
Frais de tests de biocompatibilité ISO 10993
Le coût des tests de biocompatibilité des dispositifs médicaux ISO 10993 est de 4 000 USD, avec un cycle de 4 semaines ( test de cytotoxicité , test de sensibilisation et irritation cutanée) ; notre laboratoire possède les sceaux de qualification CNAS et CMA et est un laboratoire autorisé GLP qui peut vous aider à fournir des rapports de test de compatibilité en chinois et en anglais ;
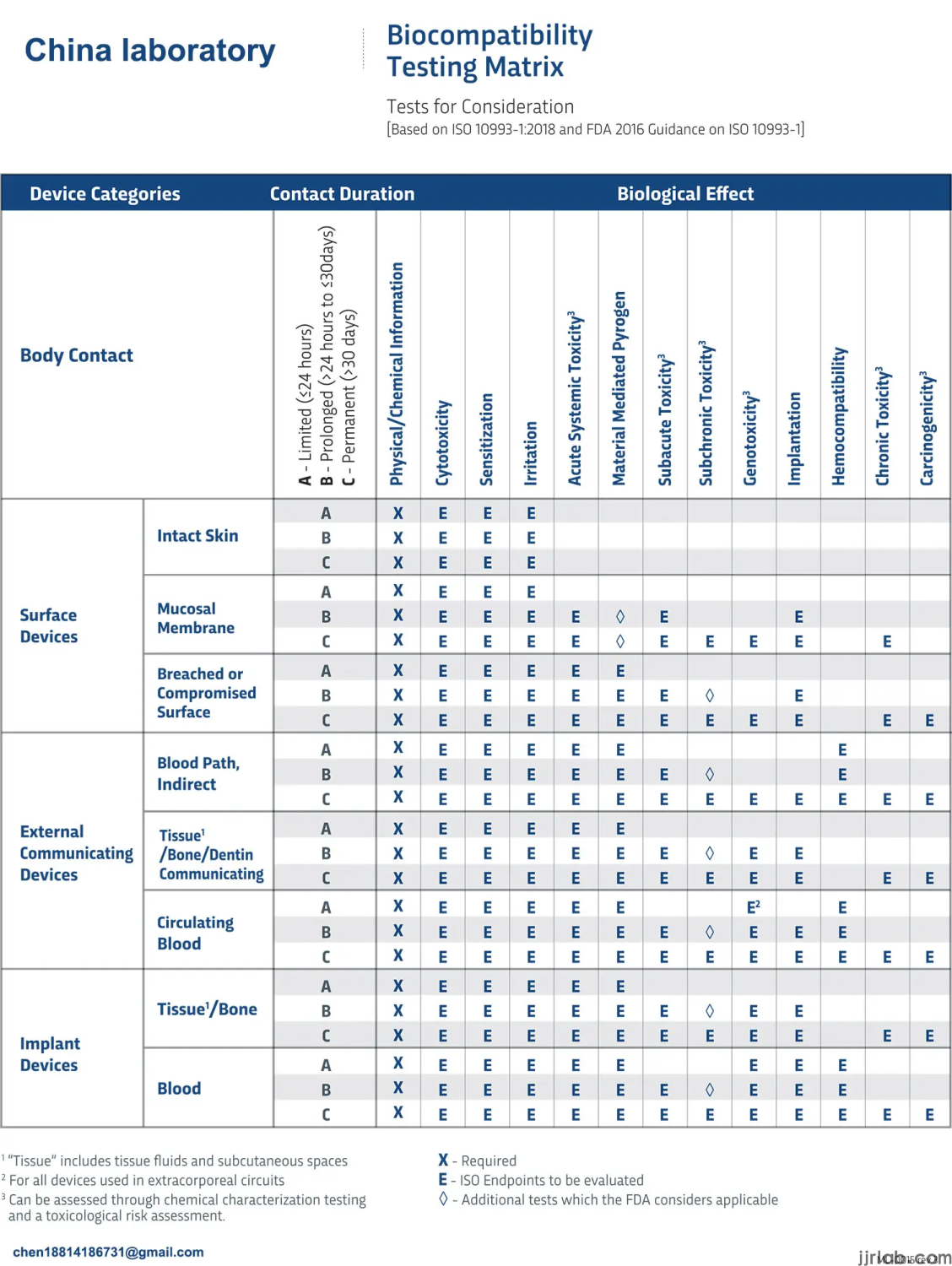
La biocompatibilité est une mesure de la compatibilité d'un dispositif ou d'un matériau avec un système biologique. La norme iso 10993-1:2018 définit la biocompatibilité comme « l'aptitude d'un dispositif ou d'un matériau médical à fonctionner avec une réponse appropriée de l'hôte dans une application spécifique ».
L'objectif principal de la présente partie de l'ISO 10993 est de protéger les personnes contre les risques potentiels liés à l'utilisation des dispositifs médicaux (iso 10993-1:2018). Les fabricants doivent mieux comprendre les matériaux, la fabrication, la stérilisation et les autres procédés des dispositifs médicaux avant de réaliser des essais de biocompatibilité. La norme ISO 10993-1:2018 met l'accent sur la caractérisation de la CMI avant les essais de biocompatibilité in vitro et in vivo.
Courriel : chen18814186731@gmail.com

Cytotoxicité in vitro – iso 10993-5
La cytotoxicité est un test de biocompatibilité réalisé sur des cellULes de mammifères en culture . Le PBL réalise trois tests de cytotoxicité in vitro : élution MEM, surcouche d'agarose et contact direct.
Extraits et lixiviables des équipements – ISO 10993-18
Généralement, la caractérisation et l'analyse chimiques des composants du dispositif, également appelées tests des extractibles et des lixiviables, sont réalisées avant tout test biologique. Cela implique l'extraction des matières lixiviables d'un dispositif ou d'un composant à haute température et l'analyse de l'extrait à l'aide de divers instruments.

Test d'hémolyse - astm f756 :
Nous réalisons des tests d'hémolyse par méthodes directes et par extraction afin d'évaluer les effets indésirables des dispositifs médicaux, des substances relargables et des matières biologiques sur le sang de lapin. Ce test est idéal pour évaluer la compatibilité sanguine des dispositifs médicaux et des matières biologiques, conformément aux normes internationales ISO 10993-4:2017 et ASTM F756.
Tests de biocompatibilité in vivo :
Une fois les tests in vitro terminés, des tests biologiques in vivo seront réalisés. Leurs types de tests dépendront de l'utilisation prévue du dispositif. Les tests in vivo peuvent aller de l'irritation cutanée aux tests de sensibilisation, en passant par les tests d'implant et les tests de toxicité systémique. Les délais d'exécution des tests peuvent varier de trois semaines à plusieurs mois, selon les données spécifiques requises . Les études de toxicité systémique subchronique ou chronique peuvent durer plus longtemps.
Email:hello@jjrlab.com
Write your message here and send it to us
 Certifikata ROHS Kosten
Certifikata ROHS Kosten
 Services de test EN 18031
Services de test EN 18031
 Frais de tests de biocompatibilité ISO 10993
Frais de tests de biocompatibilité ISO 10993
 Exigences de certification EN71 pour les jouets po
Exigences de certification EN71 pour les jouets po
 Certification CE de l’UE : Directives LVD, EMC et
Certification CE de l’UE : Directives LVD, EMC et
 Test d'étanchéité IP67
Test d'étanchéité IP67
 Certification d'étanchéité IP67
Certification d'étanchéité IP67
 Produit Electronique Certification ROHS
Produit Electronique Certification ROHS
Leave us a message
24-hour online customer service at any time to respond, so that you worry!




