
Hämokompatibilitätstest nach ISO 10993
ISO 10993-4:2017 Interpretation von Normen für Hämokompatibilitätstests
Medizinische Geräte, die in direkten oder indirekten Kontakt mit menschlichem Blut kommen, müssen Hämokompatibilitätstests unterzogen werden, wenn nicht genügend Daten vorliegen, um die Einhaltung der Anforderungen an die Blutkompatibilität nachzuweisen. iso 10993-4:2017 ist ein wichtiger Referenzstandard für solche Tests. Heute wird das chinesische JJR-Labor die Anforderungen dieses Standards interpretieren und die Testprotokolle untersuchen.
Übersicht über Hämokompatibilitätstests
Hämokompatibilitätstests bewerten die Auswirkungen von medizinischen Geräten oder Materialien im Kontakt mit Blut oder Blutprodukten. Bei der Auswahl und Gestaltung von Testprotokollen sollten Faktoren wie Produktdesign, klinische Verwendung, Umgebung und Risiko-Nutzen-Analyse berücksichtigt werden.
Die ISO 10993-4:2017 als essentielle Referenz beinhaltet im Wesentlichen drei Komponenten:
1. Klassifizierung von Medizinprodukten, die mit Blut in Kontakt kommen.
2. Grundlegende Merkmale zur Beurteilung von Blutreaktionen.
3. Auswahl der Testmethoden.
Klassifizierung von Geräten, die mit Blut in Kontakt kommen
Als Geräte ohne Blutkontakt werden Geräte bezeichnet, die weder direkt noch indirekt mit dem im Körper verbleibenden oder in den Körper zurückgeführten Blut interagieren, wie etwa In-vitro-Diagnostikreagenzien und Blutentnahmeröhrchen.
Externe Kommunikationsgeräte interagieren im Allgemeinen mit dem zirkULierenden Blut und stellen eine Verbindung zum menschlichen Gefäßsystem her. Beispiele hierfür sind Blutentnahmegeräte, Katheter, Blutlagerungs- oder -transportgeräte wie Blutbeutel und Transfusionsschläuche, Gefäßkatheter und intravenöse Verlängerungen. Weitere Beispiele sind Atherektomiegeräte, Blutüberwachungssysteme, kardiopulmonale Bypasskreisläufe, therapeutische Bluttrenngeräte, extrakorporale Membranoxygenatoren, Dialysegeräte, Herzinterventionsgeräte und Gefäßführungsdrähte.
Implantierbare Geräte haben über einen längeren Zeitraum Kontakt mit Blut und umfassen Anuloplastieringe, arteriovenöse Shunts, implantierbare Monitore, Herzunterstützungssysteme, künstliche Herzen, Embolisationsgeräte, synthetische Gefäßtransplantate, implantierbare Defibrillatoren, Herzschrittmacherkabel, Stents und ähnliche Produkte.
Blutreaktionseigenschaften
Nach der Identifizierung der Gerätekategorie ist es wichtig, die Blutreaktionseigenschaften des Produkts zu verstehen, um geeignete Testmethoden auszuwählen. Zwei wichtige Punkte sind zu beachten:
– Die Norm bietet ein Entscheidungsflussdiagramm zur Bestimmung, ob ein Hämokompatibilitätstest erforderlich ist.
- Die Norm listet Gerätebeispiele mit entsprechenden Prüfkategorien auf.
Mithilfe der Beantwortung der folgenden vier Fragen können Sie feststellen, ob ein Hämokompatibilitätstest erforderlich ist:
1. Kommt das Gerät direkt oder indirekt mit dem zirkulierenden Blut in Kontakt? Falls nicht, gilt diese Norm nicht. Falls ja, fahren Sie mit der nächsten Frage fort.
2. Stimmen die Materialien des Geräts hinsichtlich Verarbeitung, Struktur, physikochemischen Eigenschaften, Sterilisationsmethoden und klinischer Anwendung mit denen der vermarkteten Produkte überein? Wenn alles übereinstimmt, sind keine Tests erforderlich. Andernfalls fahren Sie fort.
3. Können Unterschiede bewertet und als akzeptabel befunden werden? Wenn ja, sind Tests unnötig, wenn nicht, ist eine weitere Risikobewertung erforderlich.
4. Sind die Daten aus der Risikobewertung zur Blutverträglichkeit akzeptabel? Falls ja, ist eine Prüfung nicht erforderlich, andernfalls ist eine Prüfung gemäß den einschlägigen Richtlinien erforderlich.
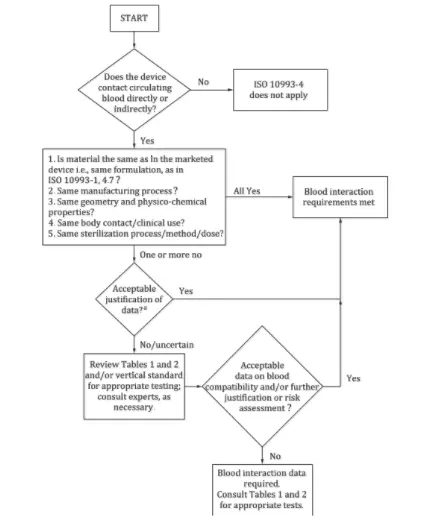
Zu den Geräten, die getestet werden müssen, zählen beispielsweise Blutüberwachungsgeräte, bei denen möglicherweise Hämolyse-, Gerinnungs-, Thrombozytenaktivierungs- und Hämatologietests erforderlich sind.
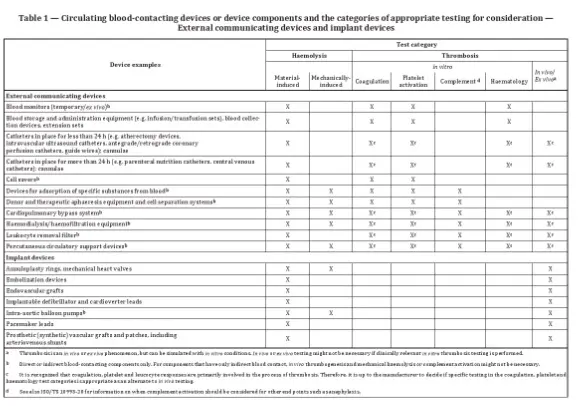
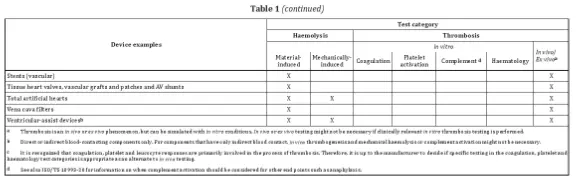
Zu berücksichtigende Parameter sind unter anderem das strukturelle Design, physikochemischen Eigenschaften, Oberflächeneigenschaften, Sterilisationsbedingungen, Kontaktdauer, Temperatur und Blutfluss bzw. Antikoagulationsbedingungen. Bei implantierbaren Produkten sollten die Tests klinische Bedingungen möglichst genau simulieren.
Beschreibung der Testmethoden
Im Allgemeinen umfassen Hämokompatibilitätstests zwei Hauptkategorien:
1. Hämolysetests: Diese können stofflich oder mechanisch vermittelt sein.
2. Thrombosetests: Dazu gehören In-vitro-Tests zur Gerinnung, Thrombozytenaktivierung und Komplementaktivierung sowie In-vivo- und Ex-vivo-Tests.
Zu den wichtigsten Überlegungen bei In-vitro-Tests zählen Hämatokrit, Art und Dosierung des Antikoagulans, Vorbereitung der Blutprobe, Temperatur, pH-Wert, Strömungsbedingungen und Blut/Oberflächen-Verhältnisse.
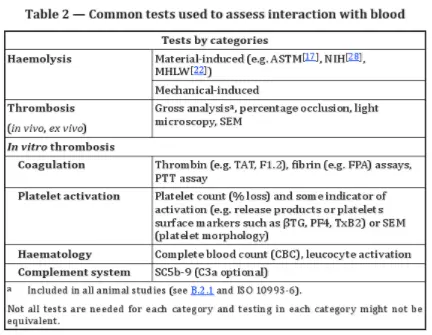
Ex-vivo-Tests sind für extrakorporale Geräte wie Dialysesysteme unerlässlich. Mit diesen Tests können die Thrombozytenadhäsion, die Thrombusbildung und die Fibrinogenablagerung überwacht werden. Veränderungen des Blutflusses in Echtzeit können auf Thrombusablagerung und Embolisation hinweisen.
Bei implantierbaren Geräten wie Gefäßstents sollten In-vivo-Tierstudien klinische Bedingungen simulieren. Zu den wichtigsten Bewertungskriterien gehören die Durchgängigkeit des Geräts und die histopathologische Beurteilung nach der Entfernung. Fortgeschrittene Techniken wie Angiographie oder intravaskulärer Ultraschall (IVUS) können ebenfalls zum Einsatz kommen.
Abschluss
ISO 10993-4:2017 beschreibt die Klassifizierung von Medizinprodukten, die mit Blut in Kontakt kommen, grundlegende Blutreaktionseigenschaften und Standardtestmethoden. Detaillierte Anleitungen zu Testdesigns, wie z. B. In-vivo-Thrombose- oder Thrombozytenaktivierungstests, sind jedoch in den Anhängen AG des Standards zu finden.
Verweise
[1] ISO 10993-4:2017 Biologische Beurteilung von Medizinprodukten - Teil 4: Auswahl von Prüfungen auf Wechselwirkungen mit Blut
Email:hello@jjrlab.com
Write your message here and send it to us
 Was sind RoHS und REACH?
Was sind RoHS und REACH?
 IC Kanada-Zertifizierungslogo?
IC Kanada-Zertifizierungslogo?
 Was ist EN 55024-Prüfung?
Was ist EN 55024-Prüfung?
 Einführung in CE-, RoHS- und FCC-Zertifizierungen
Einführung in CE-, RoHS- und FCC-Zertifizierungen
 Wie viel kostet die IEC 60601-1-2-Prüfung?
Wie viel kostet die IEC 60601-1-2-Prüfung?
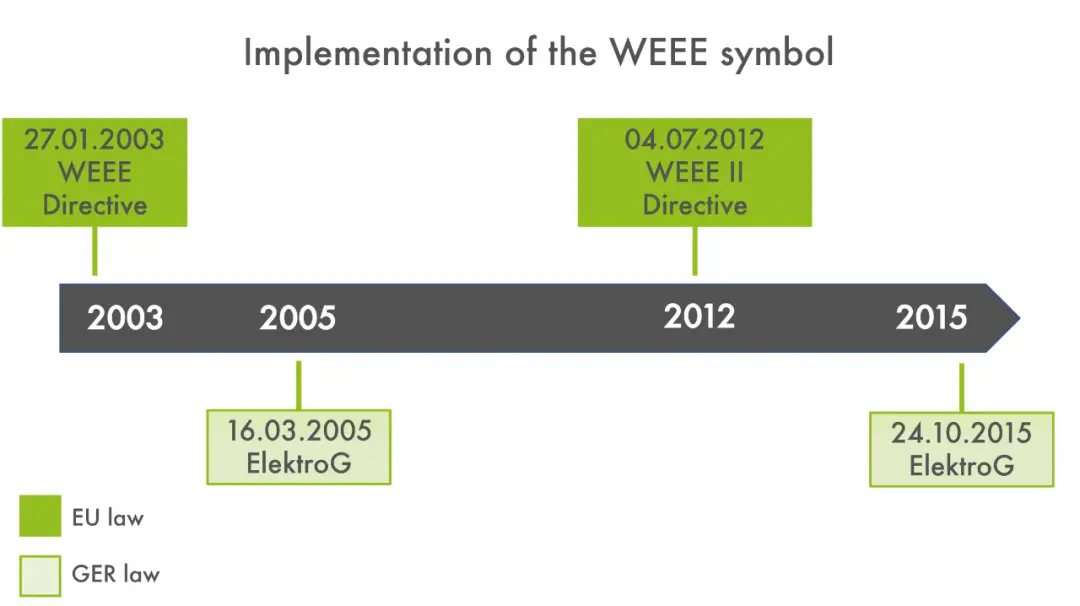
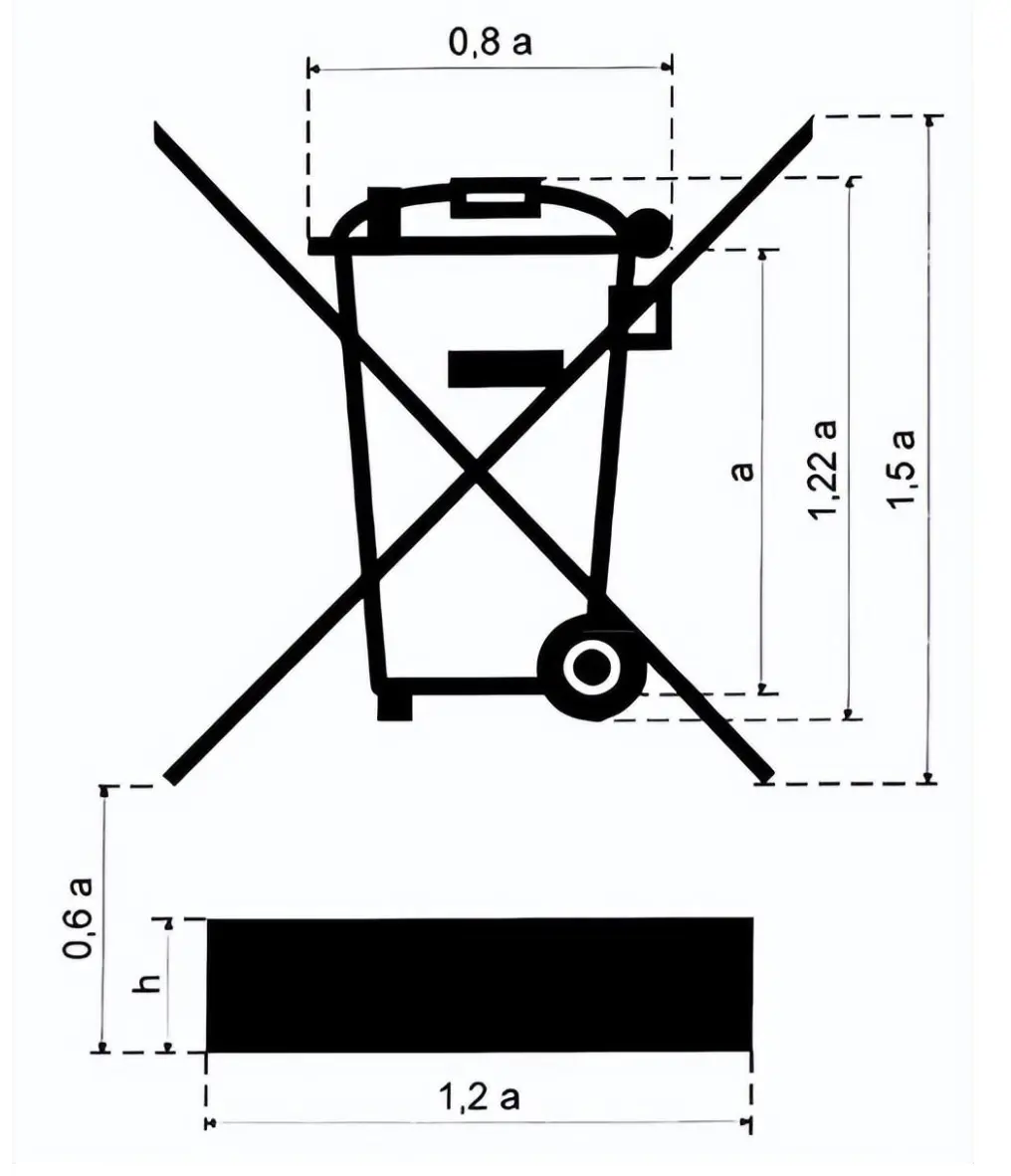 Was ist das WEEE-Label?
Was ist das WEEE-Label?
 WEEE-Logo Größenanforderungen
WEEE-Logo Größenanforderungen
 Was bedeutet FCC ID?
Was bedeutet FCC ID?
Leave us a message
24-hour online customer service at any time to respond, so that you worry!




