
Was ist die CE IVD Zertifizierung?
Das chinesische JJR-Labor bietet deutschen Herstellern von In-vitro-Diagnostika (IVD) umfassende Unterstützung bei der Erstellung technischer Dokumentationen und der CE-Zertifizierung gemäß den EU-Vorgaben.
In diesem Artikel erfahren Sie:
- Wie ist der regULatorische Prozess für In-vitro-Diagnostika (IVD) in der EU?
- Wie ist die Klassifizierung von In-vitro-Diagnostika (IVD) in der EU geregelt?
- Welche Änderungen gibt es in den Anforderungen an In-vitro-Diagnostika (IVD) unter der neuen In-vitro-Diagnostik-Verordnung (IVDR)?
CE-IVD Zertifizierung und die neue EU-IVD-Verordnung
In-vitro-Diagnostika (IVD) benötigen eine CE-Zertifizierung, um in der EU verkauft werden zu können.
Die neue EU-Verordnung für In-vitro-Diagnostika (IVDR 2017/746) trat im Mai 2022 in Kraft. Im Vergleich zur EU-Richtlinie für In-vitro-Diagnostika (IVDD 98/79/EC) gab es wesentliche Änderungen in den regulatorischen Anforderungen für IVD.
Klassifizierung von In-vitro-Diagnostika (IVD) in der EU
Die Verordnung für In-vitro-Diagnostika (IVDR) unterteilt IVDs je nach Risikoniveau in vier Klassen:
- Klasse A
- Klasse B
- Klasse C
- Klasse D
Die meisten Selbsttests für In-vitro-Diagnostika gehören zur Klasse C, während viele Geräte, die derzeit als selbstzertifiziert gelten, in eine höhere Risikoklasse eingestuft werden.
Der CE-Zertifizierungsprozess für In-vitro-Diagnostika ähnelt dem für medizinische Geräte, weist jedoch auch wichtige Unterschiede auf.
Laden Sie unser Flussdiagramm herunter, um den CE-Zertifizierungsprozess für In-vitro-Diagnostika zu verstehen.
IVDR Technische Dokumentationsdienstleistungen
Hersteller von In-vitro-Diagnostika müssen eine technische Dokumentation erstellen, die bestätigt, dass ihr Produkt den Anforderungen der IVDR entspricht.
Diese Dokumentation muss Informationen zu Design, beabsichtigtem Gebrauch, Risikobewertung und dem Compliance-Weg der IVDR-Anforderungen enthalten.
Je nach Klassifizierung des IVDs müssen einige Geräte von einer Benannten Stelle geprüft werden, die das CE-Zertifikat ausstellt. Nach Fertigstellung muss die Dokumentation jederzeit auf Anfrage der zuständigen EU-Behörden vorgelegt werden.
Im Rahmen des EU-Registrierungsservices für IVDs kann Emergo by UL folgende Unterstützung anbieten:
- Bestimmung der korrekten Klassifizierung Ihres IVDs (wenn unklar).
- Festlegung der spezifischen Testanforderungen sowie der anwendbaren Normen und MEDDEV-Dokumente.
- Prüfung bestehender Dokumente auf Übereinstimmung mit den grundlegenden Anforderungen der IVDR 2017/746.
- Überprüfung bestehender technischer Dokumentationen oder Designakten zur Identifikation und Erklärung von Mängeln.
- Bewertung klinischer Nachweise und Erstellung eines klinischen Nachweisdokuments.
- Unterstützung bei der Auswahl einer Benannten Stelle.
- Übernahme der Rolle des offiziellen Bevollmächtigten in der EU.
- Durchführung von Risikobewertungen gemäß EN ISO 14971:2012.
- Unterstützung bei der Erstellung von Überwachungs- und Nachmarktverfahren.
- Hilfe bei der Überprüfung der ISO 13485:2016-Standardanforderungen und der Vorbereitung auf Zertifizierungsaudits (falls erforderlich).
JJR-Labor: Ihr Partner in der globalen IVD-Registrierung
Das JJR-Labor aus China vertritt weltweit hunderte von IVD-Unternehmen. Wir haben diese Unternehmen erfolgreich bei der Registrierung von Tausenden von IVD-Produkten in der EU sowie vielen anderen Märkten unterstützt.
Häufig gestellte Fragen zu In-vitro-Diagnostika (IVD) und der CE-Zertifizierung in der EU
1. Benötigen wir einen autorisierten Vertreter (EC REP), wenn wir selbstzertifizierte In-vitro-Diagnostika (IVD) verkaufen?
Ja. Wenn Sie keinen Sitz in Europa haben, müssen Sie einen EC REP wählen, unabhängig davon, welche Art oder Klassifizierung Ihr IVD hat.
2. Müssen alle Arten von IVDs von einer Benannten Stelle geprüft werden?
Es sei denn, Sie verkaufen ein selbstzertifiziertes In-vitro-Diagnostikum (IVD), benötigen Sie die Beteiligung einer Benannten Stelle und das von dieser ausgestellte CE-Zertifikat.
Tatsächlich wird gemäß der neuen EU-Verordnung für In-vitro-Diagnostika (IVDR 2017/746) der Großteil der IVD-Hersteller im Rahmen des Konformitätsbewertungsverfahrens eine Benannte Stelle beauftragen müssen.
Wir hoffen, dass dieser Überblick Ihnen bei der Vorbereitung Ihrer CE-IVD-Zertifizierung hilft. Bei weiteren Fragen stehen wir Ihnen gerne zur Verfügung!
Email:hello@jjrlab.com
Write your message here and send it to us
 Was sind RoHS und REACH?
Was sind RoHS und REACH?
 IC Kanada-Zertifizierungslogo?
IC Kanada-Zertifizierungslogo?
 Was ist EN 55024-Prüfung?
Was ist EN 55024-Prüfung?
 Einführung in CE-, RoHS- und FCC-Zertifizierungen
Einführung in CE-, RoHS- und FCC-Zertifizierungen
 Wie viel kostet die IEC 60601-1-2-Prüfung?
Wie viel kostet die IEC 60601-1-2-Prüfung?
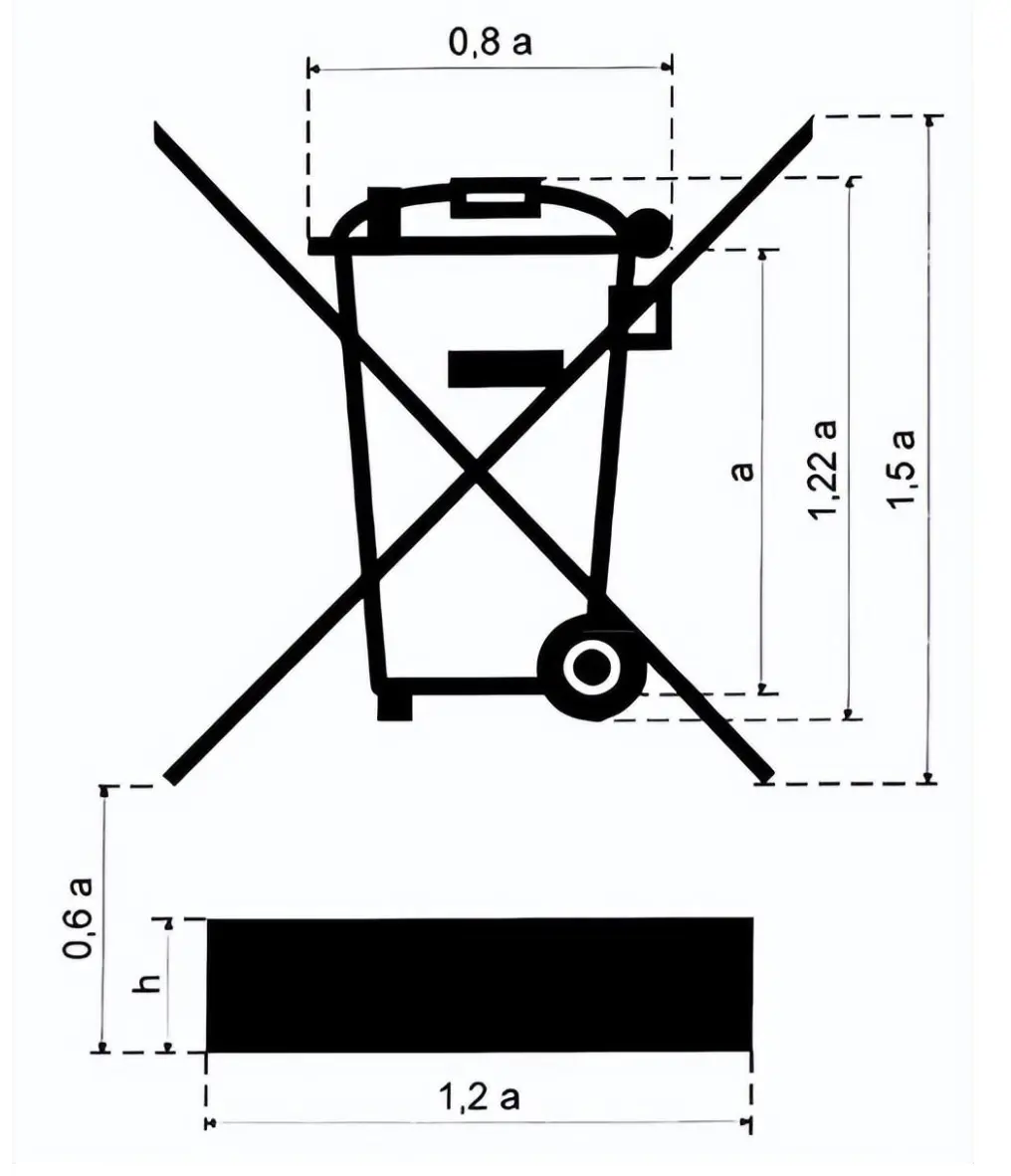 Was ist das WEEE-Label?
Was ist das WEEE-Label?
 WEEE-Logo Größenanforderungen
WEEE-Logo Größenanforderungen
 Was bedeutet FCC ID?
Was bedeutet FCC ID?
Leave us a message
24-hour online customer service at any time to respond, so that you worry!




