
Kosten der CE-Zertifizierung für Medizinprodukte
Die Kosten für die CE-Zertifizierung medizinischer Geräte liegen bei Standardprodukten normalerweise zwischen 8.000 und 12.000 US-Dollar. Bei komplexeren Produkten können die Kosten mehrere Zehntausend Dollar betragen.

Um Medizinprodukte auf dem EU-Markt verkaufen zu können, müssen Hersteller strenge gesetzliche Anforderungen erfüllen. Die CE-Zertifizierung ist ein wichtiges Kennzeichen, das die Einhaltung der EU-Normen für Gesundheit, Sicherheit und Umweltschutz gewährleistet. Nachfolgend finden Sie eine detaillierte Aufschlüsselung des CE-Zertifizierungsprozesses:
Verstehen Sie die geltenden EU-Vorschriften
• EU-Medizinprodukteverordnung (MDR) 2017/745: Ab Mai 2021 müssen alle Medizinprodukte der MDR entsprechen, die die frühere Medizinprodukterichtlinie (93/42/EWG) und die In-vitro-Diagnostik-Richtlinie (98/79/EG) ersetzt.
• In-vitro-Diagnostik-Verordnung (IVDR) 2017/746: Gilt für In-vitro-Diagnostika und legt den Schwerpunkt auf klinische Nachweise und Risikobewertung.
Bestimmen Sie die Produktklassifizierung
Medizinprodukte werden in der EU nach Risikokategorien klassifiziert, die die Zertifizierungsanforderungen bestimmen. Die Hauptkategorien sind:
• Klasse I (geringes Risiko): Eine Selbstzertifizierung ist ohne Zustimmung einer benannten Stelle zULässig.
• Klasse IIa und IIb (mittleres Risiko): Überprüfung durch eine benannte Stelle erforderlich.
• Klasse III (hohes Risiko): Muss einer Überprüfung durch eine benannte Stelle mit strengen klinischen Daten und Bewertungen unterzogen werden.
Die Klassifizierung richtet sich nach dem Verwendungszweck, dem Grad des Kontakts mit dem menschlichen Körper und der damit verbundenen Risikobewertung.
Konformitätsbewertung
Durch die Konformitätsbewertung wird sichergestellt, dass das Produkt den gesetzlichen Anforderungen der EU entspricht. Basierend auf der Klassifizierung müssen die Hersteller Folgendes durchführen:
• Technische Dokumentation: Bereiten Sie detaillierte technische Dateien zu Design, Herstellung, klinischer Bewertung und Risikomanagement vor.
• Klinische Bewertung und Tests: Bei Geräten mit hohem Risiko müssen Daten aus klinischen Tests die Sicherheit und Wirksamkeit nachweisen. Bei Geräten mit geringem Risiko können Literaturberichte oder vorhandene Daten herangezogen werden.
• Risikomanagement: Bewerten Sie potenzielle Risiken und implementieren Sie entsprechende Kontrollmaßnahmen.
Wählen Sie eine Benannte Stelle
Abhängig von der Risikokategorie benötigen Hersteller möglicherweise eine Benannte Stelle, um das Produkt zu prüfen und zu zertifizieren:
• Klasse I: Keine Beteiligung einer benannten Stelle erforderlich.
• Klasse II und III: Wählen Sie eine von der EU akkREDitierte Benannte Stelle zur Überprüfung der technischen Dokumentation und der Qualitätsmanagementsysteme (z. B. ISO 13485).
Die Wahl der Benannten Stelle hängt von der Produktkategorie und -komplexität ab. Hersteller sollten darauf achten, dass die ausgewählte Stelle über die erforderliche Qualifikation und Erfahrung in der Zertifizierung von Medizinprodukten verfügt.
Qualitätsmanagementsystem (QMS)
• ISO 13485: Der Standard für Qualitätsmanagementsysteme für Medizinprodukte. Die meisten Produkte mit mittlerem BIS hohem Risiko müssen der ISO 13485 entsprechen. Die benannte Stelle prüft die Produktions- und Managementprozesse des Herstellers.
Vor der CE-Zertifizierung müssen Hersteller ein wirksames QMS einrichten und aufrechterhalten, um die Qualitätskontrolle während der gesamten Produktentwicklung und -produktion sicherzustellen.
Klinische Daten und Bewertung
• Die klinische Bewertung ist für alle Medizinprodukte obligatorisch und umfasst:
§ Klinische Studien: Zum Nachweis der Sicherheit und Wirksamkeit für den vorgesehenen Gebrauch.
§ Vorhandene klinische Daten: Geräte mit geringem Risiko können vorhandene Daten zur Unterstützung der Sicherheit und Wirksamkeit nutzen.
Für Produkte der Klasse III sind klinische Studien und ein ausführlicher klinischer Bewertungsbericht erforderlich.
Technische Dokumentation und Konformitätserklärung
• Technische Dokumentation: Enthält detaillierte Beschreibungen des Produktdesigns, Risikobewertungen, Leistungstests und klinischer Daten.
• Konformitätserklärung (DoC): Hersteller stellen eine DoC aus, in der sie bestätigen, dass das Produkt alle gesetzlichen Anforderungen der EU erfüllt, und legen diese bei der CE-Zertifizierung vor.
Verwendung des CE-Zeichens
• Nach der Zertifizierung dürfen Hersteller ihr Produkt mit dem CE-Zeichen versehen, um die Einhaltung der EU-Vorschriften zu signalisieren.
• Jegliche Änderungen oder Aktualisierungen am Produkt müssen die fortlaufende Konformität mit der CE-Zertifizierung gewährleisten.
Marktüberwachung und Überwachung nach dem Inverkehrbringen
• EWR-Marktüberwachung: Hersteller müssen nach dem Markteintritt eine fortlaufende Einhaltung der Vorschriften sicherstellen. Die EU-Mitgliedsstaaten führen regelmäßige Inspektionen durch, um die Einhaltung der Vorschriften durchzusetzen.
• Meldung von Vorfällen: Hersteller müssen unerwünschte Ereignisse (z. B. Produktmängel oder Anwendungsrisiken) der Europäischen Arzneimittel-Agentur (EMA) oder den nationalen Aufsichtsbehörden melden und Korrekturmaßnahmen ergreifen.
Wichtige Änderungen bei der MDR-Konformität
Die neue MDR stellt im Vergleich zur vorherigen Richtlinie strengere Anforderungen, darunter:
• Verbesserte Überwachung während des gesamten Produktlebenszyklus.
• Schwerpunkt auf klinischen Daten und Studien, insbesondere bei Geräten mit hohem Risiko.
• Erhöhte Anforderungen an die Nachverfolgung nach der Markteinführung, wie z. B. „Nachmarktüberwachung“ und „Vorfallberichterstattung“.
• Eindeutige Geräteidentifikation (UDI) für alle medizinischen Geräte, um die Rückverfolgbarkeit zu erleichtern.
Die CE-Zertifizierung ist ein wichtiger Schritt zur Gewährleistung der Konformität von Medizinprodukten und umfasst alle Phasen vom Design und der klinischen Bewertung bis zur Marktaufsicht. Hersteller müssen die EU-Vorschriften (MDR/IVDR) verstehen und einhalten, um Sicherheit, Wirksamkeit und Konformität zu gewährleisten. Die CE-Zertifizierung ermöglicht nicht nur den Zugang zum EU-Markt, sondern steigert auch die internationale Wettbewerbsfähigkeit.
Email:hello@jjrlab.com
Write your message here and send it to us
 Was sind RoHS und REACH?
Was sind RoHS und REACH?
 IC Kanada-Zertifizierungslogo?
IC Kanada-Zertifizierungslogo?
 Was ist EN 55024-Prüfung?
Was ist EN 55024-Prüfung?
 Einführung in CE-, RoHS- und FCC-Zertifizierungen
Einführung in CE-, RoHS- und FCC-Zertifizierungen
 Wie viel kostet die IEC 60601-1-2-Prüfung?
Wie viel kostet die IEC 60601-1-2-Prüfung?
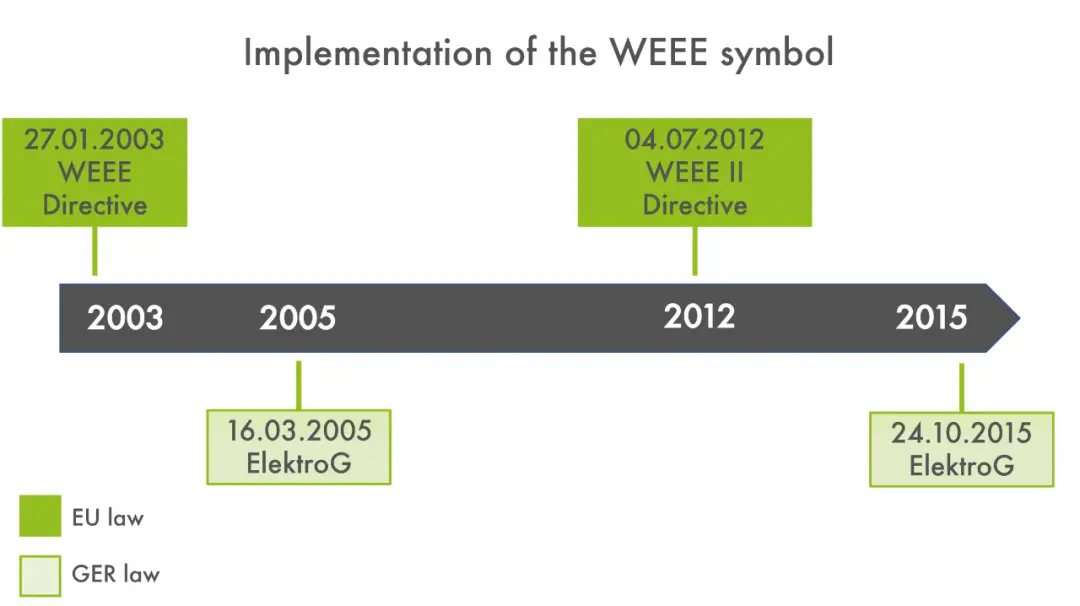
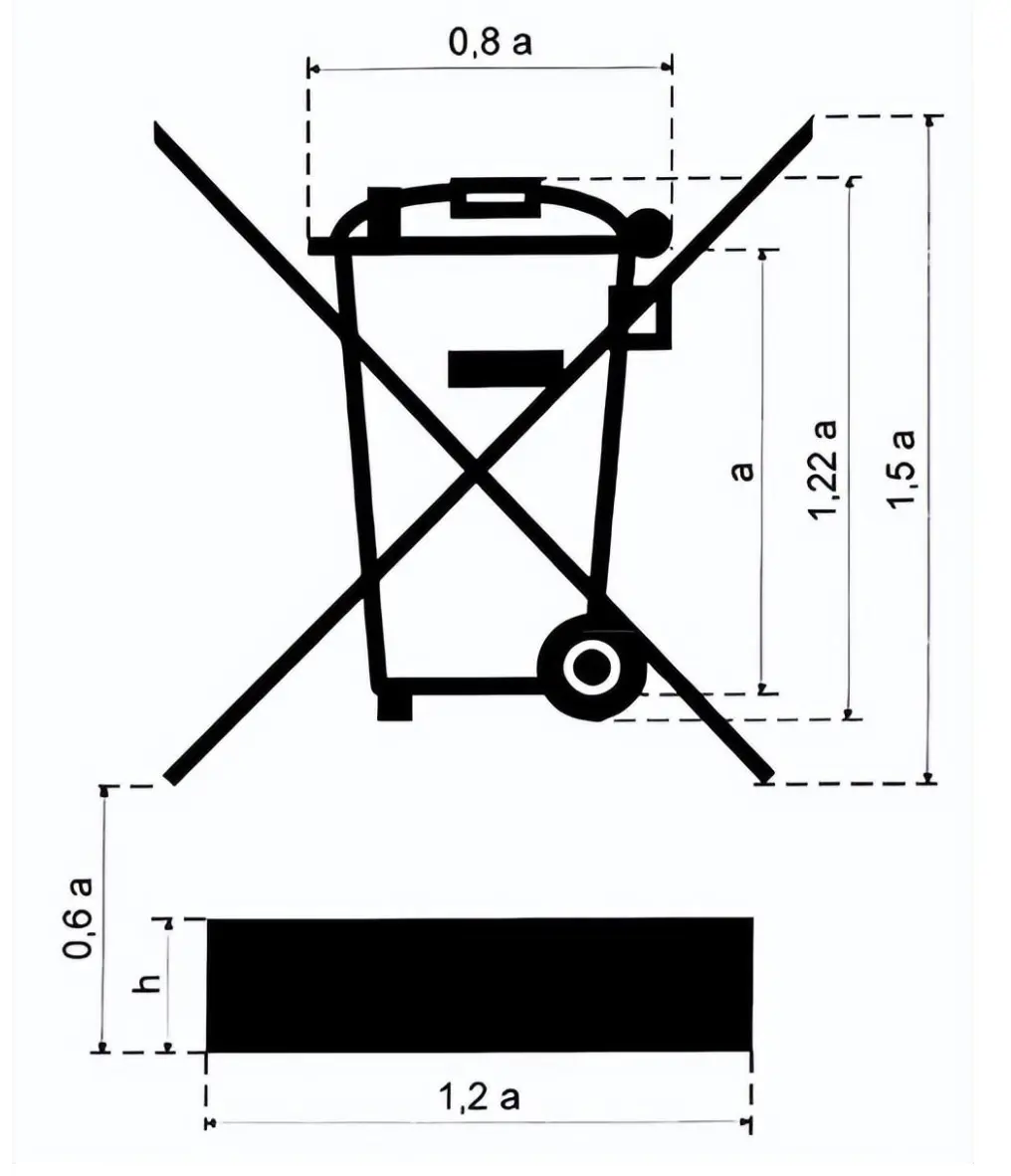 Was ist das WEEE-Label?
Was ist das WEEE-Label?
 WEEE-Logo Größenanforderungen
WEEE-Logo Größenanforderungen
 Was bedeutet FCC ID?
Was bedeutet FCC ID?
Leave us a message
24-hour online customer service at any time to respond, so that you worry!




