
MDR-Zertifizierung Zertifizierung Medizinprodukte
Kurze Einführung
Die EU besteht aus 27 Mitgliedstaaten und umfasst eine Fläche von 4,14 Millionen Quadratkilometern, die weite Teile Europas abdeckt.
- Geografische Reichweite: Westen zum Atlantik, Osten zur GUS, Süden zum Mittelmeer, Norden zur Ostsee.
- Abgedeckte Länder: Alle europäischen Länder außer Großbritannien, GUS und dem westlichen Balkan.
- Hauptsitz: Brüssel, Belgien.
Bevölkerung und Verwaltungsstruktur
1. Bevölkerungsverteilung
- Die Gesamtbevölkerung der 27 EU-Staaten beträgt etwa 450 Millionen.
- Die fünf bevölkerungsreichsten Länder: Deutschland, Frankreich, Italien, Spanien, Polen.
2. Mitgliedstaaten
Österreich, Belgien, BULgarien, Zypern, Tschechien, Kroatien, Dänemark, Estland, Finnland, Frankreich, Deutschland, Griechenland, Ungarn, Irland, Italien, Lettland, Rumänien, Litauen, Luxemburg, Malta, Niederlande, Polen, Portugal, Slowakei, Slowenien, Spanien, Schweden.
Exportübersicht 2024
- Im Zeitraum Januar BIS Juni 2024 exportierte China medizinische Geräte im Wert von etwa 40,58 Milliarden RMB in die EU, was einem Anstieg von 10,11 % entspricht.
Datenquelle: Guangzhou Zhongcheng Big Data Technology Co., Ltd.
- Die EUDAMED-Datenbank verzeichnete 47.956 neue medizinische Geräteprodukte, davon wurden 4.624 Produkte von chinesischen Unternehmen selbst eingetragen.
Datenquelle: Pure Cert Medical Technology (Guangzhou) Co., Ltd.
EU-Vorschriften und Aufsichtsbehörden für Medizinprodukte
- Die zuständigen Behörden & benannten Stellen überwachen gemeinsam die Medizinprodukte:
- Benannte Stelle: Verantwortlich für die Zertifizierung von Medizinprodukten.
- Zuständige Behörde: Verantwortlich für die AkkREDitierung der benannten Stellen und die Überwachung nach dem Inverkehrbringen.
- Rechtsgrundlage: „Verordnung über Medizinprodukte (MDR, VERORDNUNG (EU) 2017/745)“
Veröffentlicht im Mai 2017, verpflichtend ab Mai 2021.
Es wurden fast 140 Leitlinien zur Verordnung veröffentlicht (MDCG-Leitlinien & Q&A).
Definition von Medizinprodukten
1. Definition von Medizinprodukten
Nach der MDR (VERORDNUNG (EU) 2017/745 umfasst der Begriff „Medizinprodukt“ unter anderem:
- Zur Diagnose, Vorbeugung, Überwachung, Vorhersage, Prognose, Behandlung oder Linderung von Krankheiten.
- Zur Diagnose, Überwachung, Behandlung, Linderung oder Kompensation von Verletzungen oder Behinderungen.
- In-vitro-Diagnostikgeräte (zur Analyse von Körperproben zur medizinischen Information).
- Geräte zur Kontrolle oder Unterstützung der Schwangerschaft.
- Reinigungs-, Desinfektions- und Sterilisationsprodukte (für Medizinprodukte).
2. Erweiterung des Medizinproduktbegriffs durch die MDR
Im Vergleich zur ursprünglichen MDD-Richtlinie umfasst die MDR:
- Kontaktlinsen, Fettentfernungsgeräte, Laser-/Intensivlichtgeräte zur Hautbehandlung u.a.
- Strengere Anforderungen an den Austausch von Komponenten und Teilen.
Klassifizierung von Medizinprodukten
1. Klassifikationskriterien
Gemäß Anhang VIII der MDR sind die Medizinprodukte wie folgt klassifiziert:
- Regel 1 - Regel 4: Nicht-invasive Geräte
- Regel 5 - Regel 8: Invasive Geräte
- Regel 9 - Regel 13: Aktive Geräte
- Regel 14 - Regel 22: Besondere Regelungen
MDCG-Leitlinien:
- MDCG 2021-24: Leitlinien zur Klassifizierung von Medizinprodukten
- MDCG 2022-5: Leitlinien zur Grenzziehung zwischen Medizinprodukten und Arzneimitteln
- MDCG 2019-11: Leitlinien zur Zertifizierung und Klassifizierung von Software
2. Klassifikation
Nach Risikoklassen unterteilt:
- Klasse I (gewöhnliche I, Is (steril), Im (Messfunktion), Irs (wiederverwendbare chirurgische Instrumente))
- Klasse IIa
- Klasse IIb
- Klasse III (höchste Risikoklasse)
MDR führt Irs (wiederverwendbare chirurgische Instrumente) in Klasse I ein. Gewöhnliche Produkte der Klasse I können selbst erklärt werden, alle anderen benötigen eine Zertifizierung durch eine benannte Stelle.
Zertifizierungsprozess für Medizinprodukte
1. Registrierungsprozess
- Technische Dokumentenprüfung (einschließlich klinischer Prüfung)
- Systeminspektion vor Ort (Phasen 1 und 2)
- Interne Zertifizierung durch die benannte Stelle
2. Zertifizierungsdauer
- Es gibt keine einheitliche Zertifizierungsdauer. Für gewöhnliche IIa/IIb-Produkte liegt die Zertifizierungsdauer bei etwa 1,5 bis 2 Jahren.
- Aufgrund begrenzter Ressourcen bei den benannten Stellen wird Herstellern empfohlen, den Zertifizierungsprozess frühzeitig zu starten.
3. Zertifizierungskosten
- Es gibt keine einheitlichen Standards, die Kosten variieren je nach benannter Stelle, Risikoklasse und technischen Merkmalen.
- Die Kosten für die Zertifizierung eines normalen IIa-Produkter liegen zwischen 300.000 und 450.000 RMB.
Referenzgebühren der benannten Stellen:
- NB2797 BSI (NL)
- NB0123 TUV SUD (DE)
- NB0197 TUV Rheinland (DE)
- NB1639 SGS (BE)
EUDAMED-Datenbank und UDI
- Die sechs Module der EUDAMED (teilweise bereits aktiviert):
1. Registrierung der Wirtschaftsbeteiligten
2. Einzigartige Geräteidentifikation (UDI) und Geräte Registrierung
3. Benannte Stellen und Zertifikate
4. Klinische Studien und Leistungsbewertungen
5. Vigilanzsysteme und Nachvermarktungsüberwachung
6. Marktüberwachung
- UDI (Einzigartige Geräteidentifikation) System:
- Basic UDI-DI: Für Gerätefamilien mit ähnlichem Verwendungszweck, Risikoklasse und Design.
- UDI: Ein eindeutiger Produktbezeichner, der auf dem Produktetikett/Verpackung angegeben und in der Datenbank registriert werden muss.
Klinische Bewertungsanforderungen
1. Ziel der klinischen Bewertung
- Nachweis, dass das Medizinprodukt die grundlegenden Sicherheits- und Leistungsanforderungen (GSPRs) erfüllt.
- Bewertung des klinischen Nutzen-Risiko-Verhältnisses des Produkts.
2. Quellen klinischer Daten
- Eigene klinische Prüfungsdaten
- Klinische Daten von gleichwertigen Geräten (technisch, biologisch, klinisch gleichwertig)
- Klinische Daten aus der Nachvermarktungsüberwachung
3. Anforderungen an wesentliche Gleichwertigkeit
- Technische Gleichwertigkeit: Ähnlicher Entwurf, Funktionsweise, Leistung.
- Biologische Gleichwertigkeit: Verwendung gleicher Materialien, Kontaktstellen mit dem menschlichen Körper sind gleich.
- Klinische Gleichwertigkeit: Anwendbar auf die gleichen Patienten unter denselben klinischen Bedingungen.
1. CE-gekennzeichnete Produkte müssen die von der benannten Stelle genehmigte Endversion der Gebrauchsanweisung und Etiketten verwenden.
2. Benannte Stellen können stichprobenartige Prüfungen durchführen: Einige Kategorien (IIa, IIb) können zusätzliche Prüfungen erfordern.
3. Strengere Anforderungen an das Nachvermarktungsüberwachungssystem (PMS), proaktive Überwachung von unerwünschten Ereignissen erforderlich.
Email:hello@jjrlab.com
Write your message here and send it to us
 Was sind RoHS und REACH?
Was sind RoHS und REACH?
 IC Kanada-Zertifizierungslogo?
IC Kanada-Zertifizierungslogo?
 Was ist EN 55024-Prüfung?
Was ist EN 55024-Prüfung?
 Einführung in CE-, RoHS- und FCC-Zertifizierungen
Einführung in CE-, RoHS- und FCC-Zertifizierungen
 Wie viel kostet die IEC 60601-1-2-Prüfung?
Wie viel kostet die IEC 60601-1-2-Prüfung?
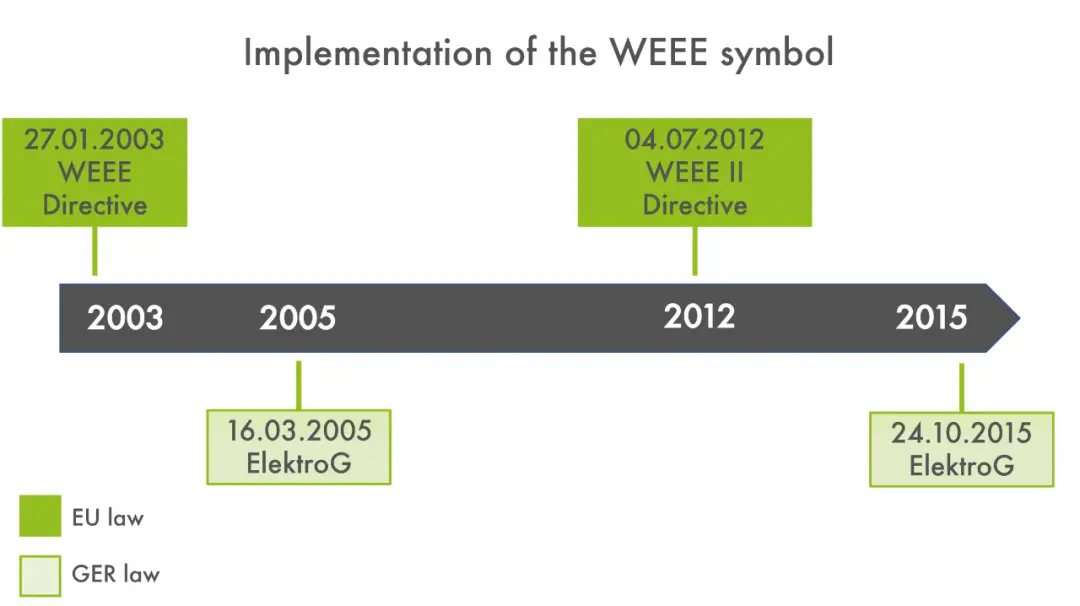
 Was ist das WEEE-Label?
Was ist das WEEE-Label?
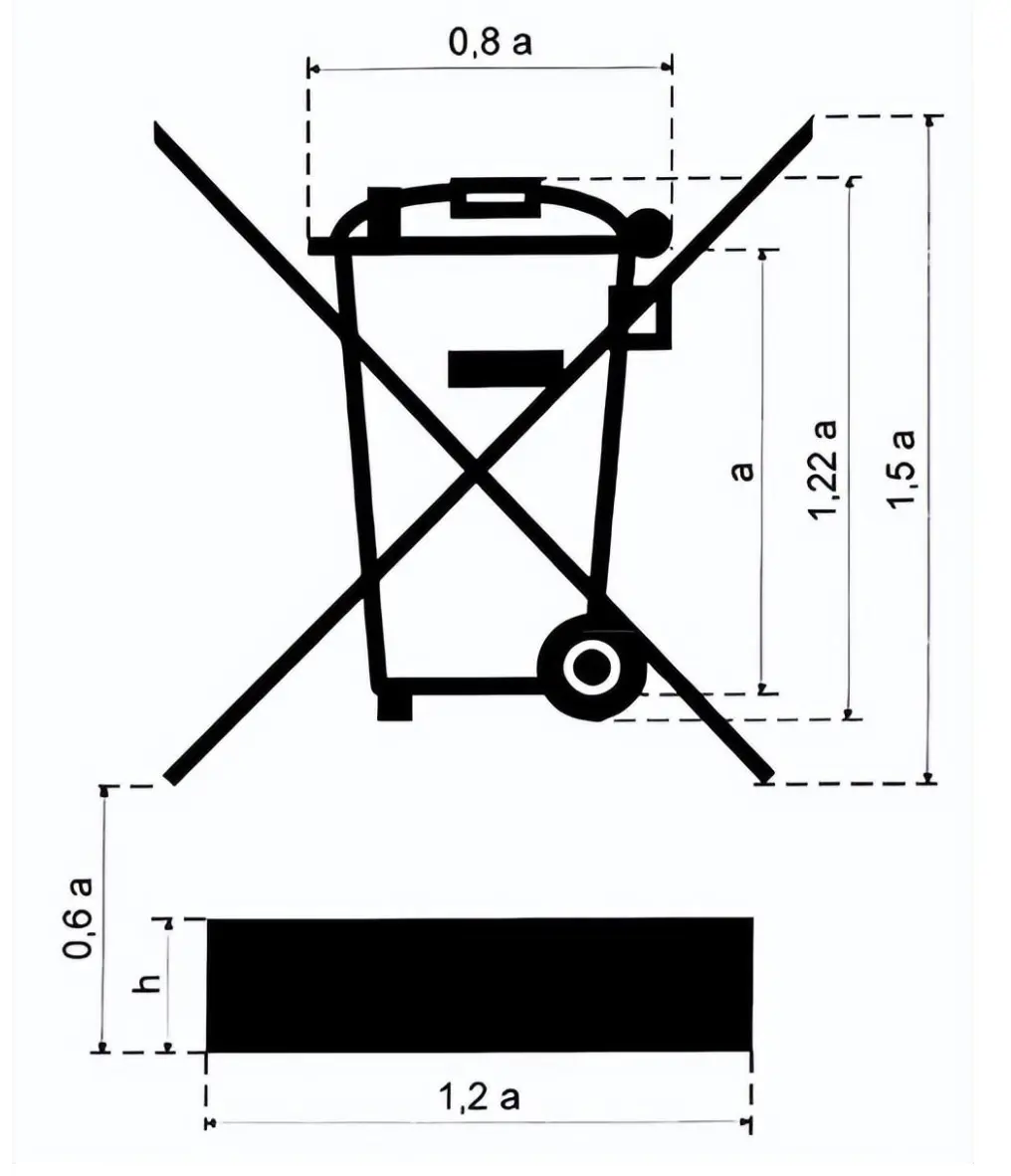
 WEEE-Logo Größenanforderungen
WEEE-Logo Größenanforderungen
 Was bedeutet FCC ID?
Was bedeutet FCC ID?
Leave us a message
24-hour online customer service at any time to respond, so that you worry!




