
ISO 10993 Biokompatibilitätstestgebühren
Die Kosten für den Biokompatibilitätstest für Medizinprodukte nach ISO 10993 betragen 4.000 US-Dollar bei einem Zyklus von 4 Wochen ( Test auf Zytotoxizität , Sensibilisierung und Hautreizung). Unser Labor verfügt über die Qualifikationssiegel von CNAS und CMA und ist ein GLP-autorisiertes Labor, das Ihnen bei der Bereitstellung chinesischer und englischer Kompatibilitätstestberichte behilflich sein kann.
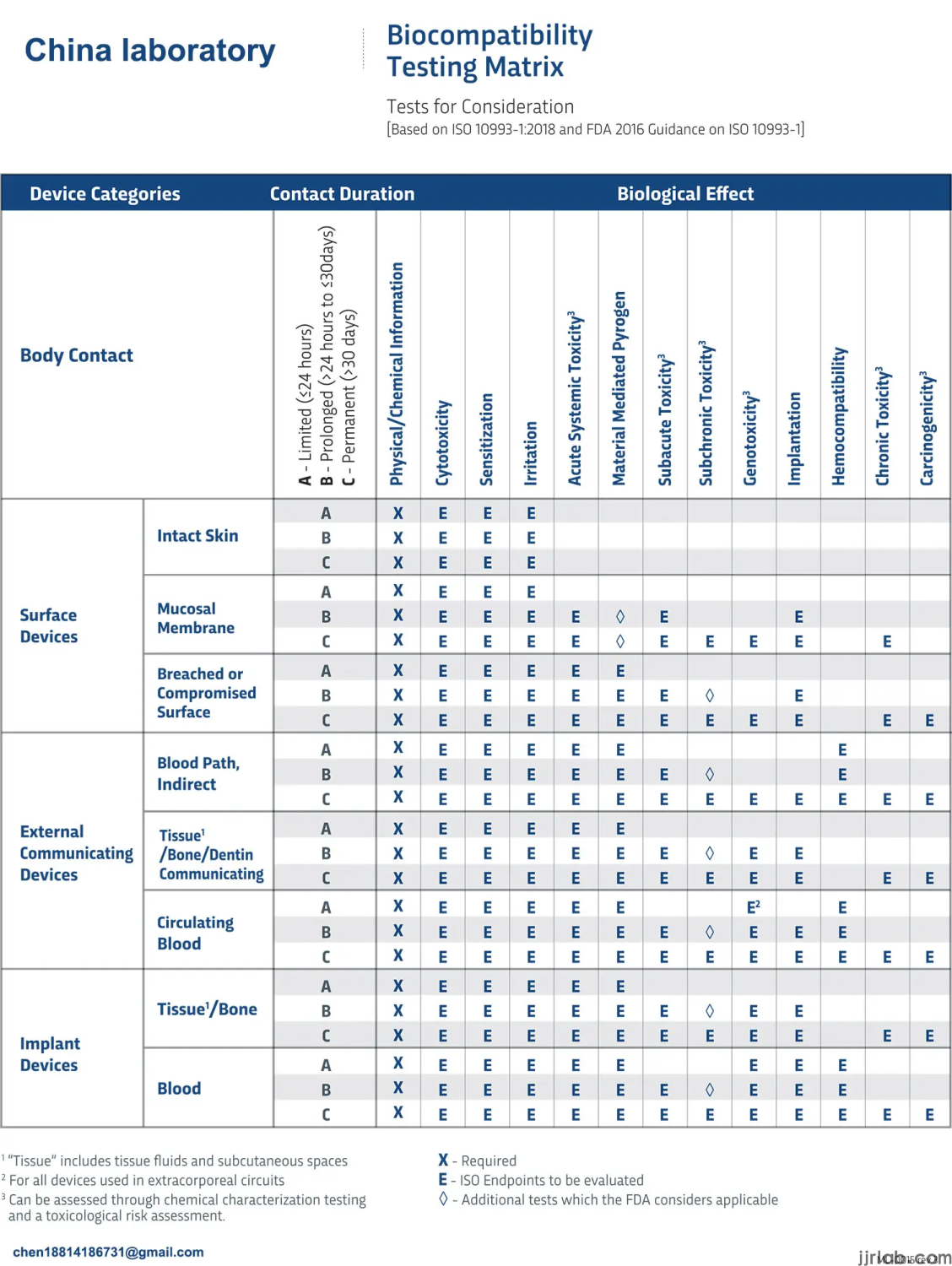
Biokompatibilität ist ein Maß für die Kompatibilität eines Geräts oder Materials mit einem biologischen System. Die Norm iso 10993-1:2018 definiert Biokompatibilität als „die Fähigkeit eines medizinischen Geräts oder Materials, in einer bestimmten Anwendung mit einer angemessenen Wirtsreaktion zu funktionieren“.
„Der Hauptzweck dieses Teils der ISO 10993 besteht darin, Menschen vor potenziellen Risiken zu schützen, die sich aus der Verwendung von Medizinprodukten ergeben.“ (iso 10993-1:2018). Hersteller müssen die Materialien, die Herstellung, die Sterilisation und andere Prozesse der Produkte besser verstehen, bevor sie Biokompatibilitätstests durchführen. Die Norm ISO 10993-1:2018 legt den Schwerpunkt auf die chemische und mikrobiologische Charakterisierung vor In-vitro- und In-vivo-Biokompatibilitätstests.
E-Mail: chen18814186731@gmail.com

In-vitro-Zytotoxizität – ISO 10993-5
Zytotoxizität ist ein Biokompatibilitätstest, der an Säugetierzellen in c UL- Umgebung durchgeführt wird. PBL führt drei In-vitro-zytotoxizitätstests durch: MEM-Elution, Agarose-Overlay und Direktkontakt.
Geräteextrakte und auslaugbare Stoffe – ISO 10993-18
Typischerweise wird vor biologischen Tests eine chemische Charakterisierung und Analyse der Gerätekomponenten durchgeführt, die auch als Geräteextraktions- und Auslaugbarkeitstests bezeichnet wird. Dabei wird auslaugbares Material bei hohen Temperaturen aus einem Gerät oder einer Komponente extrahiert und der Extrakt mit verschiedenen Instrumenten analysiert.

Hämolysetest – astm f756:
Wir führen Hämolysetests mit Direkt- und Extraktionsmethoden durch, um die negativen Auswirkungen von Medizinprodukten, auslaugbaren Substanzen und biologischen Materialien auf Kaninchenblut zu bewerten. Dieser Test eignet sich ideal zur Bewertung der Blutverträglichkeit von Medizinprodukten und biologischen Materialien gemäß den internationalen Normen ISO 10993-4:2017 und ASTM F756.
In-vivo-Biokompatibilitätstests:
Nach Abschluss der In-vitro-Tests werden biologische In-vivo-Tests durchgeführt. Die Bandbreite der Testarten hängt vom Verwendungszweck des Produkts ab. In-vivo-Tests können von Hautreizungstests über Sensibilisierungstests bis hin zu Implantattests und systemischen Toxizitätstests reichen. Die Testdurchlaufzeiten können je nach den benötigten spezifischen Testdaten zwischen drei Wochen und mehreren Monaten variieren . Subchronische oder chronische systemische Toxizitätsstudien können länger dauern.
Email:hello@jjrlab.com
Write your message here and send it to us
 Was kostet ein LFGB-Zertifikat
Was kostet ein LFGB-Zertifikat
 CE-Kennzeichnung für Kinderspielzeug
CE-Kennzeichnung für Kinderspielzeug
 CE-Kennzeichnung für Spielzeug beantragen
CE-Kennzeichnung für Spielzeug beantragen
 Wie bekomme ich CE Kennzeichnung
Wie bekomme ich CE Kennzeichnung
 Wer benötigt eine WEEE-Nummer
Wer benötigt eine WEEE-Nummer
 Wann brauche ich eine WEEE-Nummer
Wann brauche ich eine WEEE-Nummer
 WEEE-Nummer Österreich
WEEE-Nummer Österreich
 Was kostet eine WEEE Nummer
Was kostet eine WEEE Nummer
Leave us a message
24-hour online customer service at any time to respond, so that you worry!




